乙酸的存在和物理性质
乙酸的存在
- 在食醋中含有3%~5%的乙酸,所以乙酸又被称为醋酸。在动物组织、排泄物和血液中,都存在着游离态的乙酸。
乙酸的物理性质
- 乙酸是具有强烈刺激性气味的无色液体,易溶于水和乙醇,熔点为16.6℃,沸点为118℃,易挥发。当温度低于16.6℃时,乙酸会凝结成类似冰一样的晶体,故纯净的乙酸又称冰醋酸。
乙酸的组成与结构
| 分子式 | 结构式 |
|---|---|
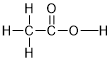 | |
| 最简式 | 电子式 |
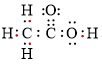 | |
| 结构简式 | 空间填充模型 |
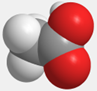 | |
| 官能团 | 分子结构模型 |
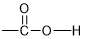 | 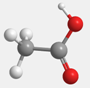 |
化学性质
乙酸分子可以看成是甲基(
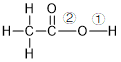
发生化学反应时,主要断裂①或②处的化学键。
酸性(断O-H键)
乙酸是一元弱酸,电离方程式为:
。 使指示剂变色:能够使紫色石蕊试液变红色。
与活泼金属反应:
与金属氧化物反应:
与碱反应:
与某些盐反应:
(醋酸除水垢的原理)
(反应利用强酸制弱酸的原理,验证了乙酸的酸性比碳酸强。酸性:
> > 。)
酯化反应(断C-O键)
概念:酸与醇反应生成酯和水的反应叫酯化反应。
反应特点:酯化反应是可逆且反应速率较为缓慢的反应。
实验操作:
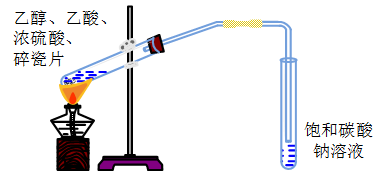
实验步骤:
在一支大试管中先加入
乙醇,然后沿着试管壁慢慢加入 浓硫酸和 乙酸并不断振荡,再加入2~3块碎瓷片以防暴沸。 如上图所示连接实验装置,用酒精灯先小火加热,再集中加热,将产生的蒸气经导管通到饱和
溶液的液面上。 实验现象:
饱和
溶液的液面上有无色且不溶于水的油状液体产生,并能闻到香味。 实验结论:
在浓硫酸、加热条件下,乙酸与乙醇反应生成了无色油状的乙酸乙酯。
反应原理:
发生酯化反应时,羧酸分子断
键,醇分子断 键,即“酸脱羟基、醇脱氢”。 注意事项:
- 实验中,乙醇和乙酸均用无水的,且注意加入试剂的顺序不能颠倒。先加乙醇,再加浓硫酸,冷却后加乙酸。
- 浓硫酸的作用:①作催化剂:加快反应速率;②作吸水剂:提高乙醇的转化率以及乙酸乙酯的产率。
- 长玻璃导管的作用:起导气与冷凝的作用。为防止倒吸,注意导气管末端不能接触液面。
- 被加热的试管要倾斜45°,其目的是增大受热面积。
- 加热时要先小火加热,再集中加热。小火加热是为了防止液体剧烈沸腾,减少反应物的挥发,并防止高温时发生炭化和其他副反应;集中加热是为了将反应产物乙酸乙酯蒸发。
- 饱和碳酸钠溶液的作用:①中和挥发出来的乙酸;②溶解挥发出的乙醇;③降低乙酸乙酯的溶解度,使溶液分层,便于得到酯。