乙醇与金属钠的反应
实验操作
- 向大试管里注入
无水乙醇,再加入一小块新切的、黄豆大小、用滤纸吸干表面煤油的金属钠。 - 在试管口迅速塞上带尖嘴导管的橡胶塞,用小试管收集气体并检验该气体纯度后,点燃,并把一干燥的小烧杯罩在火焰上方。
- 待烧杯内壁出现液滴后,迅速倒转烧杯,向烧杯中加入少量澄清石灰水,观察实验现象。
实验现象
- 试管内钠块沉入无水乙醇底部,钠块慢慢变小,表面有气泡缓慢产生。
- 气体燃烧时火焰呈淡蓝色,干燥的烧杯内壁出现液珠。
- 向烧杯中加入澄清石灰水,澄清石灰水不变浑浊。
实验结论
钠的密度比乙醇的大,钠与乙醇会发生反应生成氢气。
原理及化学方程式
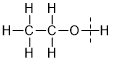 ,羟基中
,羟基中
反应实质
钠置换羟基中的氢生成氢气
注意
- 虽然
中羟基上的氢原子能被取代,但 是非电解质,不能电离出 。 - 由于钠和乙醇,水都能发生反应,所以不能用钠来检验酒精中是否含有水。
乙醇的氧化反应
乙醇的燃烧
乙醇易燃烧,燃烧时火焰呈淡蓝色,化学方程式为:
乙醇燃烧放出大量的热,燃烧产物无污染。若为不完全燃烧,还会生成一氧化碳,有黄色火焰。
乙醇具有再生性,是一种的绿色能源。
乙醇的催化氧化
实验步骤
- 向试管里注入约
无水乙醇,取一根光洁的铜丝,下端绕成螺旋状(增大铜丝的作用面积),在酒精灯上灼烧至红热。 - 趁热将铜丝插入无水乙醇中,反复几次,注意观察反应现象,小心地闻试管中液体产生的气味。
- 向试管里注入约
实验现象
- 红色光亮的铜丝灼烧后变为黑色。
- 趁热插入无水乙醇中后,铜丝表面颜色又变成红色。在每次实验中,铜丝表面的颜色变化都是”红色-黑色-红色“,原有的乙醇气味消失,闻到特殊的刺激性气味。
反应原理:
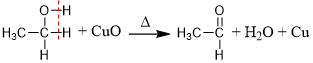 (铜丝由黑变红)。
(铜丝由黑变红)。反应实质(去H氧化)
乙醇脱去与羟基相连的碳原子上的一个氢原子和羟基上的氢原子,这两个氢原子与氧原子结合生成
。若醇分子中与羟基相连的碳原子上无氢原子,则不能被催化氧化。 总化学方程式:
(乙醇的官能团为醛基:
实验结论:
- 乙醇在加热和有催化剂(如
或 )存在等条件下,被空气中的氧气氧化成乙醛。反应的化学方程式为 。
- 乙醇在加热和有催化剂(如
乙醇与强氧化剂反应
反应原理:
乙醇能被酸性高锰酸溶液氧化成乙酸,使其紫色褪去;也能被酸性重铬酸钾(
)溶液或( )氧化成乙酸, (或 )被还原为 。化学方程式为:
(该反应常用来检测司机是否酒后驾驶车辆)
乙醇的用途
- 乙醇燃烧放出大量的热,可用作燃料。
- 乙醇是重要的有机化工原料和溶剂,用于生产医药、香料、化妆品、涂料等。
- 医疗上常用75%(体积分数)的乙醇溶液作消毒剂,碘酒也是医疗上广泛使用的消毒剂。
- 注意:乙醇进入人体后,会在肝中通过酶的催化作用被氧化成乙醛和乙酸,最终被氧化为二氧化碳和水。过量饮酒会加重肝负担,血液中较高浓度的乙醇和乙醛也会对人体产生毒害作用,所以不能过量饮酒。