原子结构的周期性变化
同周期,电子层数相同。
同周期,从左到右,核电荷数、最外层电子数逐渐增大。
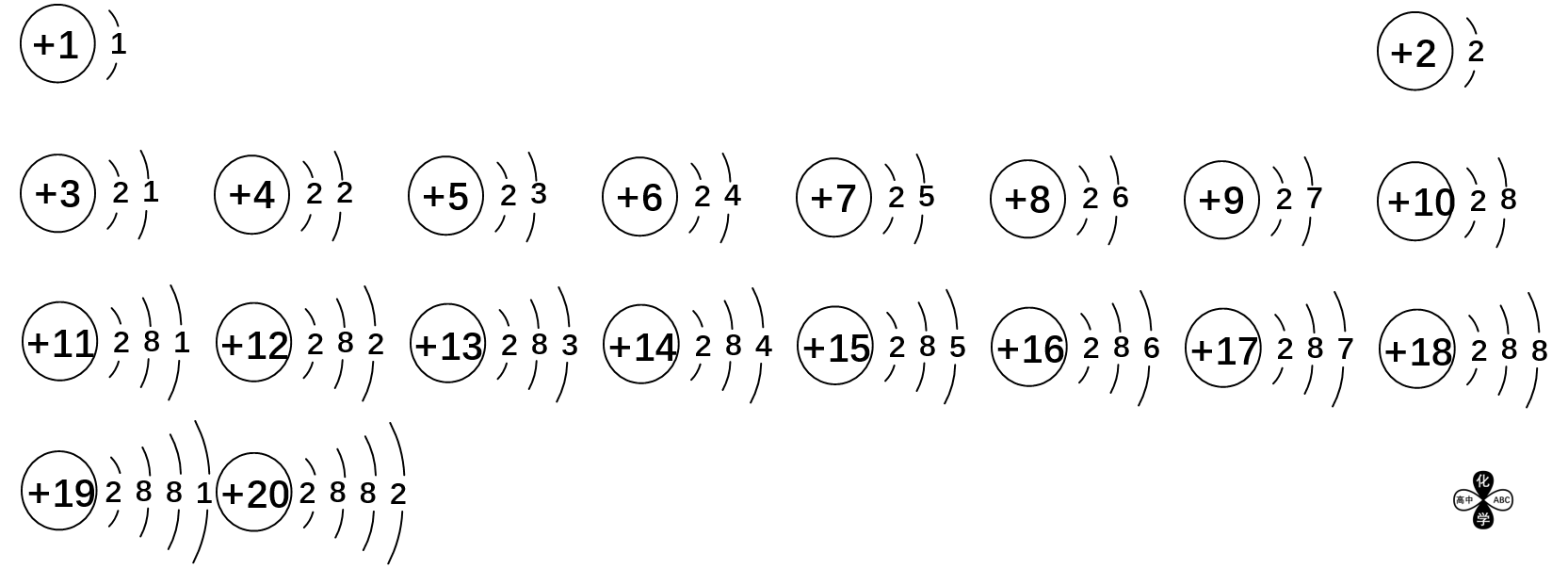
| 原子序数 | 电子层数 | 最外层电子数 | 稳定时最外层电子数 |
|---|---|---|---|
| 1~2 | 1 | 1→2 | 0或2 |
| 3~10 | 2 | 1→8 | 2或8 |
| 11~18 | 3 | 1→8 | 8 |
元素性质随原子序数的递增呈周期性变化,是原子结构随原子序数的递增呈周期性变化的必然结果。即物质结构决定性质。
原子半径的周期性变化
同周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子半径递减;
同主族中,从上到下,随着原子序数的递增,元素原子半径递增。
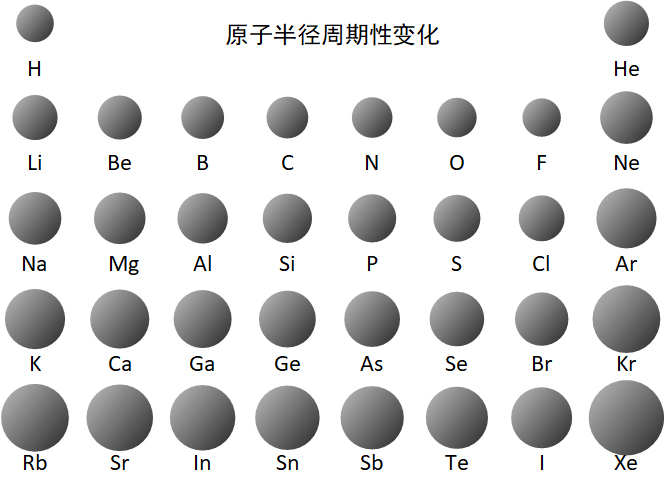
惰性气体的原子半径测量方法不一样。
元素主要化合价的周期性变化
同周期中,从左到右,随着原子序数的递增,元素的最高正化合价递增(从+1价到+7价),第一周期除外,第二周期的O、F元素除外;
由于金属元素不容易获得电子,一般无负化合价。从ⅣA族开始,最低负化合价递增(从-4价到-1价)。第一周期除外。
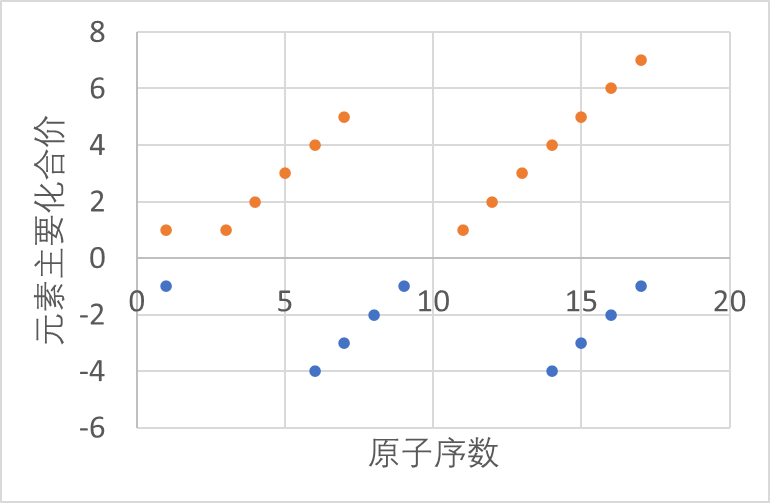
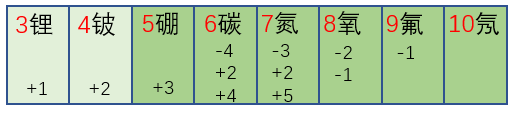
非金属元素最高价的绝对值与最低价的绝对值的和为8 (H, O, F除外)。
元素最高正价 = 最外层电子数。
元素最低负价= 最外层电子数 – 8
第三周期元素性质的递变
钠、镁与水的反应
钠与水反应
实验操作
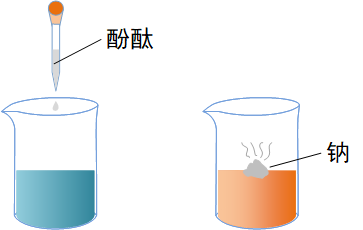
实验现象
钠熔成小球,浮于水面,四处游动,发出“嘶嘶”的响声。生成溶液滴加酚酞后变红。
镁与水反应
实验操作
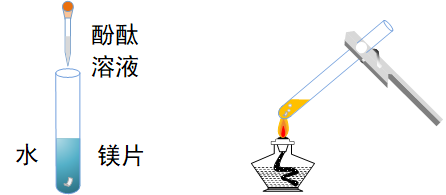
实验现象
冷水中,镁条只有少量无色气泡。加热后,无色气泡冒出速度加快。滴加了酚酞的产物溶液变红。
镁条使用前应用砂纸除去表面的氧化膜。
对比结论
的金属性强于 。
钠、镁、铝的最高价氧化物对应水化物的碱性
碱性强弱
是强碱, 是中强碱。 是两性氢氧化物。 结论
金属性:
两性氢氧化物
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,叫两性氢氧化物。
弱酸如碳酸,弱碱如氨水无法溶解
。
溶液中逐滴加入 , 先产生白色沉淀 ,然后白色沉淀溶解。
最高价氧化物对应水化物(含氧酸)的酸性强弱:
同周期
结论:
同周期主族元素性质递变规律
由于第三周期元素核外均为3个电子层,但从左至右核电荷数逐渐增多,核对核外电子的吸引越强,既金属性逐渐减弱,非金属性逐渐增强。
