分子间作用力 氢键
分子间作用力
分子间作用力(范德华力):分子间作用力是存在于分子与分子之间或惰性气体原子间的作用力,又称范德华力。
分子内作用包括共价键和离子键,分子间作用主要包括范德华力和氢键。
分子间作用力相比分子内作用力弱得多,主要影响物质的熔沸点及溶解性。
一般规律:分子的极性越强,分子间作用力越强; 组成与结构相似的物质,分子量越大,分子间作用力越强。
分子间作用力越强,熔沸点越高。如熔沸点顺序:
对溶解度的影响则是相似相溶。非极性溶质一般能溶于非极性溶剂;极性溶质一般能溶于极性溶剂。
只有共价键无范德华力的物质。
, 金刚石,晶体硅等原子晶体。
氢键
分子中的氢原子与吸电子能力很强的原子(N, O, F)相结合时,共用电子对偏离H原子很彻底,使H原子成为裸露的质核。而临近分子中的原子(N, O, F)最外层的孤对电子,对裸露的质核产生吸引,形成氢键。
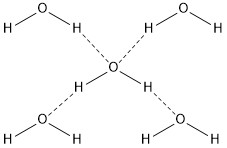
氢键存在于分子间,比分子间作用力强,比化学键弱得多。使物质熔沸点增高,在水中溶解度增大。如:
如熔沸点:
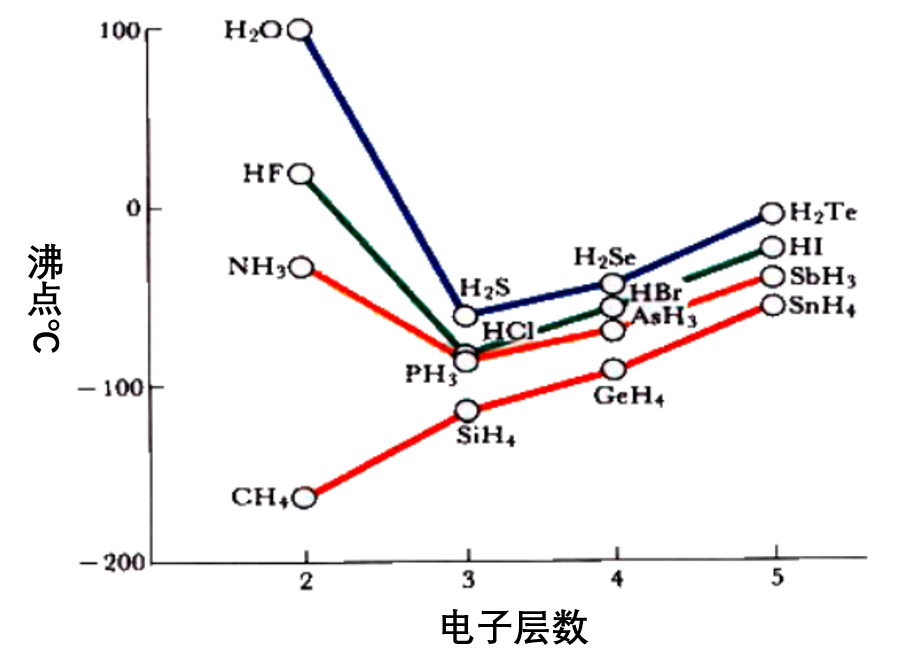
常见存在氢键的物质有:
当水温度降低时,水分子间能形成更多氢键,使水分子排列更规整,水分子间空隙增大。