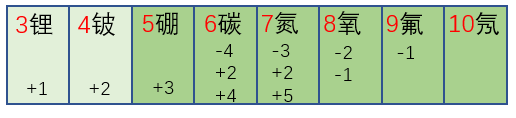
电子层
原子核外电子运动的特征
电子在原子核周围做高速绕核运动,能量低的电子在离核近的区域内运动,能量高的电子在离核远的区域内运动。
⑴ 运动微粒(电子)的质量很小,
⑵ 运动速度极高,2200km/s (约为光速的1%)。
⑶ 运动范围极小,
不能测定或计算电子在某一时刻所在的位置;无法描述电子运动的轨迹。电子层指的是某些电子出现概率最大的区域。
概念
电子在原子中处于不同的能级状态,粗略说是分层分布的,故电子层又叫能层。
电子层可用(n=1、2、3、4、5、6、7)或K、L、M、N、O、P、Q表示。
随着n值的增加,即按K、L、M、N、O…的顺序,电子的能量逐渐升高、电子离原子核的平均距离也越来越大。
电子分层排布的一般规律
- 能量最低原理
核外电子总是尽先排布在能量最低的电子层里,然后再由里往外,依次排布在能量逐步升高的电子层里。
- 数量规律
各电子层最多容纳的电子数目是
最外层电子数目不超过8个(最外层为K层时,不超过2个), 次外层电子数目不超过18个, 倒数第三层电子数目不超过32个。
如均为N层,在最外层只能容纳8个电子,在次外层只能容纳18个电子。
| K | L | M | N | O | |
|---|---|---|---|---|---|
| 最多容纳 | 2 | 8 | 18 | 32 | 50 |
| 在倒数第三层 | 2 | 8 | 18 | 32 | 32 |
| 在次外层 | 2 | 8 | 18 | 18 | 18 |
| 在最外层 | 2 | 8 | 8 | 8 | 8 |
原子核外电子排布的表示方法
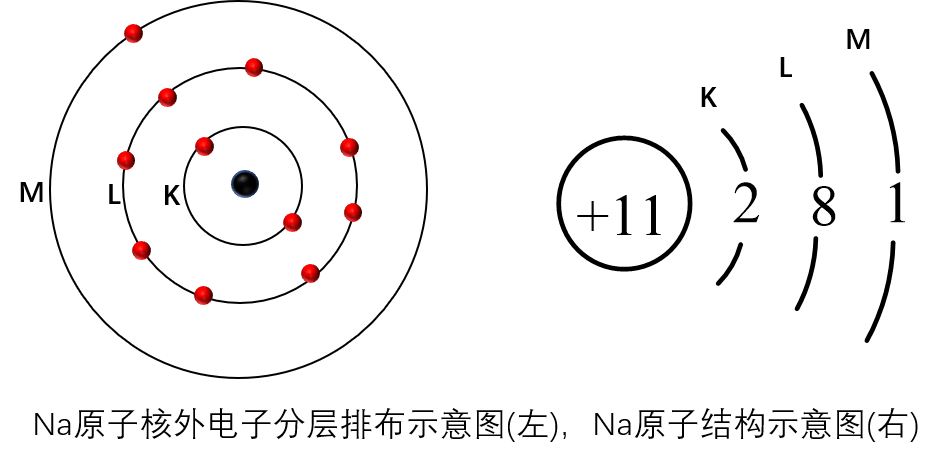
原子结构示意图中,核外电子数与质子数相等,但阴、阳离子中,核外电子数与质子数不等。
核外电子排布与元素性质的关系
元素的种类主要由质子数决定。原子的种类主要由质子数和中子数决定。原子的质量主要由质子数和中子数决定。
元素的化学性质取决于原子的最外层电子数。
- 最外层电子数小于4的元素,较易失去电子而达到稳定结构,其单质还原性较强,多为金属元素。
- 最外层电子数大于或等于4但不足8的元素,较易获得电子而达到稳定结构,其单质氧化性较强,多为非金属元素。
- 稀有气体最外层电子数有8个电子(氦为2),已达稳定结构,即不易失去电子也不易获得电子,化学性质不活泼。
- 金属元素只显正价,化合价等于其最外层电子数。
- 非金属元素通常既显正价又显负价。最高正价等于最外层电子数,最低负价等于最外层电子数减8。