氧化还原反应的基本规律
先强后弱规律
中通入少量 , 会优先氧化还原性更强的 。若 有多余,才会继续氧化 。 价态规律
最高价态,只有氧化性
中间价态,既有氧化性又有还原性
最低价态,只有还原性
价态归中
同种元素不同价态间转化时有:
高价态 + 低价态 = 中间价态, 且”只靠拢,不交叉“。
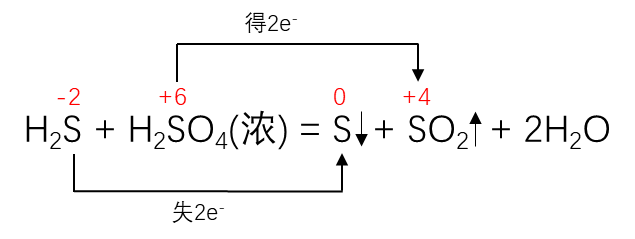
上式中的
同元素临近价态间,不发生氧化还原反应,例:
与 不发生反应。 歧化反应
同种元素间发生电子的转移或偏转。
得失电子守恒
还原剂失电子总数 = 氧化剂得电子总数
硫酸、硝酸浓度越高,氧化性越强。温度越高,氧化性越强。
如:铜与浓硫酸在加热时反应,与稀硫酸或低温时不反应。