氨的实验室基本制法
实验试剂:氯化铵和氢氧化钙固体
反应原理:
实验装置
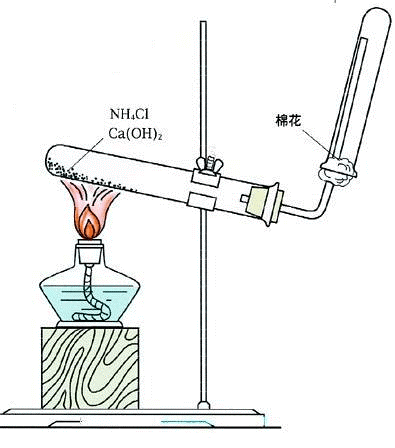
试管口略向下倾斜,防止产生的水倒流回试管底部,使试管炸裂。
收集方法:氨气密度比空气小且极易溶于水,只能用向下排空气法收集。
验满方法
- 用蘸有浓盐酸的玻璃棒接近试管口,产生白烟
- 用湿润的红色石蕊试纸接近试管口,试纸变蓝
其他制取氨气的方法:
加热浓氨水法
不稳定,易受热分解
浓氨水加固体烧碱(或生石灰、碱石灰)法
- 固体
溶于水或生石灰与水反应生成 会放出大量的热,可以促进 的分解与 的逸出;而 溶于水或生石灰与水反应也增大了溶液中 的浓度也有利于 的产生。 - 优点:不需要加热,快速制取氨气。
- 固体
工业制氨气法:
实验室制氨气注意事项
- 试管口要放一小团棉花,若为干燥的棉花,则起到减缓氨气与空气对流的作用,使收集到的氨气更纯;若棉花蘸有水或稀硫酸,还可以吸收多余的氨气。
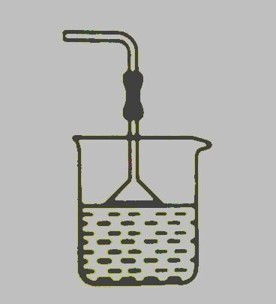
是碱性气体,能与浓硫酸发生反应,所以不能用浓硫酸来干燥氨气。也不能用 来干燥氨气,会生成 。可以用碱石灰( 和 的混合物)或氢氧化钠来干燥氨气。 易溶于水,在吸收氨气时,要防止倒吸。常采用如下装置: