胶体的分类
根据分散剂的状态分:
- 气溶胶:分散剂为气体,如:云、烟、雾
- 液溶胶:分散剂为液体,如:牛奶、豆浆、血液、墨水
- 固溶胶:分散剂为固体,如有色玻璃,土壤胶体,合金
根据胶体粒子组成分:
- 粒子胶体:由许多小分子聚集在一起形成的分子集合体。如:
胶体。 - 分子胶体:大分子形成的胶体。如:淀粉溶液
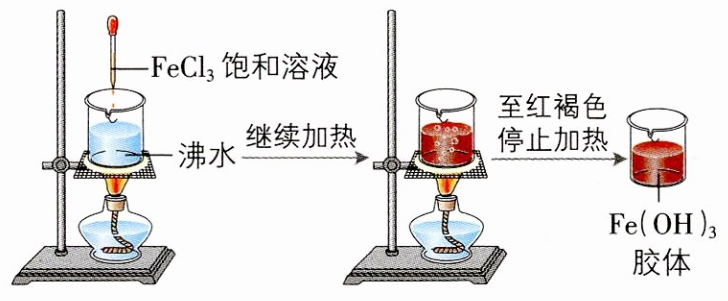
沸水中逐滴加入
- 实验用蒸馏水,自来水中有电解质。
逐滴加入,不能过量,否则胶体聚沉。 - 不能过度加热,否则胶体聚沉。
- 不能搅拌,搅拌引起胶体粒子碰撞聚沉。
书写胶体制备化学方程式时,胶体粒子后标明”胶体“,不带沉淀符号。
不能用氨水与
胶体的丁达尔效应

光束通过胶体时,从垂直于光线的方向可以看到一条光亮的“通路”。
胶粒尺寸大小,可以让光线通过,又开始散射光线。
区分溶液和胶体常用的物理方法。
布朗运动
胶体粒子总是在随机运动。
电泳
胶体粒子带电荷,在电场作用下,胶体粒子在分散剂中做定向移动。
带同种电荷的胶粒相互排斥,不容易聚沉。
血液透析,分离氨基酸和蛋白质 。
聚沉
加入电解质溶液,或加入带相反电荷的胶体粒子,从而中和原胶体粒子所带电荷能促进胶体聚沉。
加热、搅拌增大胶粒碰撞机会,也有利于胶粒聚沉。
卤水点豆腐,江河入海口三角洲,明矾净水。
溶液、胶体、浊液的比较
| 溶液 | 胶体 | 浊液 | |
|---|---|---|---|
| 分散质 | 分子、原子、离子 | 分子的集合体或高分子 | 大量分子的集合体 |
| 粒子直径 | <1 nm | 1~100 nm | >100 nm |
| 能否透过滤纸 | 能 | 能 | 不能 |
| 能否透过半透膜 | 能 | 不能 | 不能 |
| 外观 | 均一、透明 | 均一、不一定透明 | 不均一 |
| 稳定性 | 稳定 | 介稳体系 | 不稳定 |
| 丁达尔效应 | 无 | 有 | 无 |