三氧化硫
物理性质
熔点16.8℃,沸点44.8℃,在常温下为液态,标况下为固态,是无色易挥发的晶体(注意此时不能使用
化学性质
与水反应
现象:剧烈反应,同时放出大量的热。
与碱反应
与碱性氧化物反应
的制法 (催化氧化)
硫酸的工业制法
接触法制硫酸设备及流程
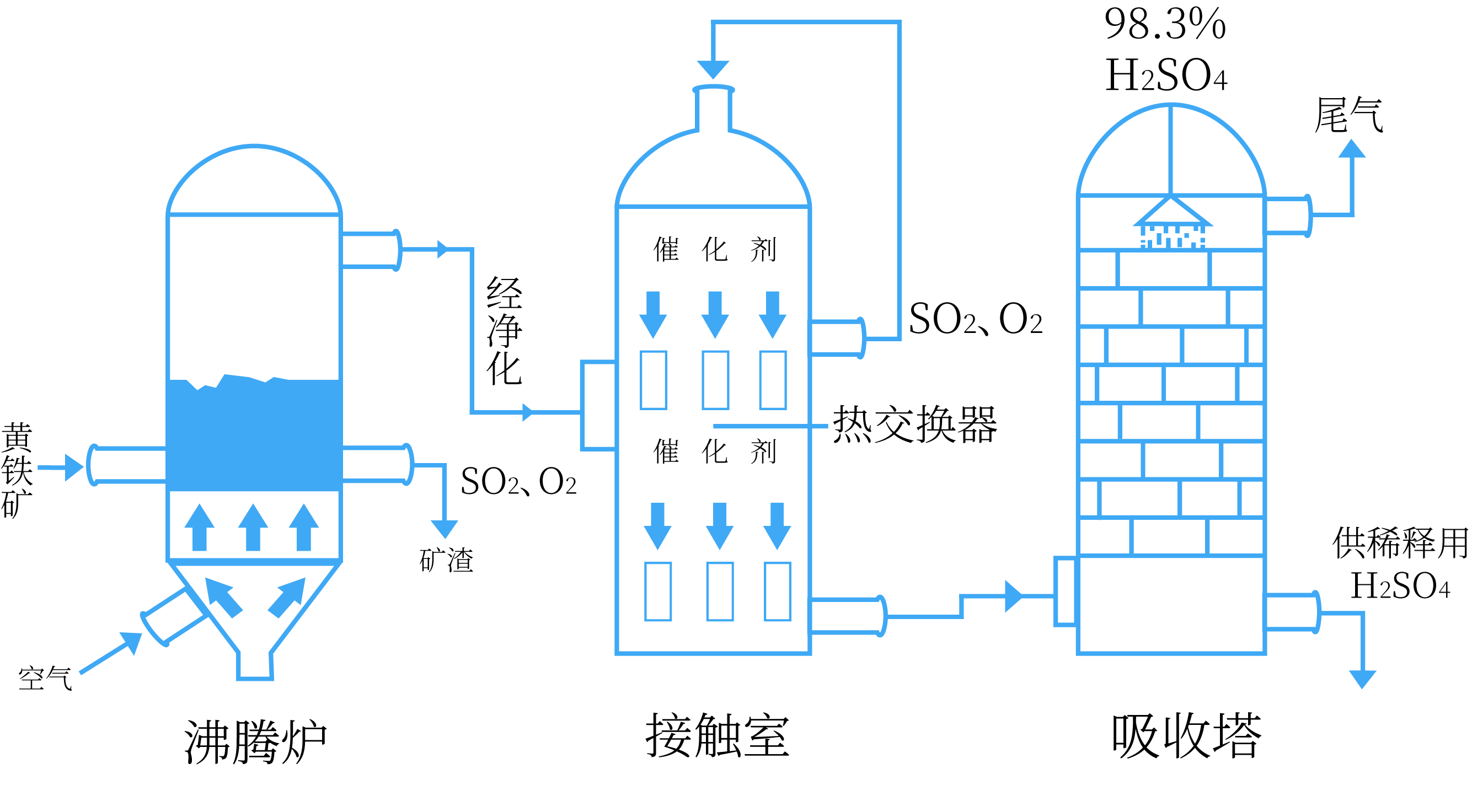
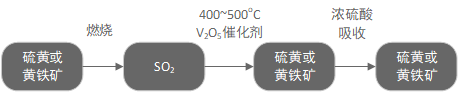
的制取、净化、干燥 设备:沸腾炉
原料:黄铁矿或硫黄
反应:
$2Fe_2O_3+8SO_2$ 或
的催化氧化 设备:接触室
原料:空气
反应:
的吸收和 的生成 设备:吸收塔
原料:98.3%的浓硫酸
反应:
注意:不能直接用水吸收
,而是用98.3%的浓硫酸吸收 以制得发烟硫酸,再根据需要用水稀释。如果直接用水吸收就会放出大量的热,形成酸雾,而导致吸收效果差。
硫酸的物理性质
- 纯硫酸是无色,粘稠的油状液体,是一种密度大、沸点高、难挥发的强酸,易溶于水,能与水以任意比互溶。
- 常见浓硫酸的质量分数为98.3%,密度为1.84
,沸点为338℃,物质的量浓度为18.4 。 - 硫酸溶液的浓度越大,密度越大。若将40%的
溶液与20%的 溶液等体积混合,所得溶液的质量分数大于30%,且稀释浓硫酸时会放出大量的热。
稀硫酸的性质
稀硫酸是强酸,电离方程式为:
稀硫酸具有酸的通性
能使紫色石蕊试液变红。
与碱发生中和反应
与碱性氧化物反应
与活泼金属(H之前)反应:
(体现酸的弱氧化性)
与某些盐反应:
浓硫酸的特性
稀释浓硫酸的方法
将浓硫酸沿器壁慢慢注入盛有水的烧杯中,并用玻璃棒不断搅拌,使产生的热量及时散出。注意不可把水倒入浓硫酸中。
浓硫酸的吸水性
浓硫酸吸取物质中本身存在的水或结晶水的性质。
浓硫酸能够吸收存在于周围环境中的水分,故可以作干燥剂,且为酸性干燥剂。
浓硫酸能干燥中性气体和酸性气体如:
、 、 、 、 、 、 、 、 等。但不能用来干燥: ①碱性气体如: ;②还原性气体如: 、 、 ;③ (注意:可以用来干燥 )。 吸收结晶水合物中的水,如把适量浓硫酸注入少量研细的胆矾中,胆矾会逐渐变为白色,体现了浓硫酸的吸水性。
浓硫酸的脱水性
浓硫酸可以将有机物如:蔗糖、棉布等中的
向蔗糖中加入浓硫酸:

实验现象
蔗糖变黑,体积膨胀,形成一种疏松多孔的海绵状的碳,同时有刺激性气味气体放出。发生的化学方程式为:
注意:该实验产生的有刺激性气味的二氧化硫是有毒气体,会污染环境,实验时可采用密封装置,吸收产生的有毒气体。
浓硫酸的强氧化性
与金属反应(浓硫酸与金属反应规律)
与活泼金属(如
)反应,开始时产生 ,硫酸浓度变小后,开始产生 。 与不活泼金属(如
)反应,开始在加热条件下产生 ,硫酸浓度变小后,稀硫酸不再与 反应。 (此时浓硫酸既表现出氧化性,又表现出酸性)
如1
与含2 的浓硫酸充分反应: 生成
物质的量小于1 。 钝化:常温下,
、 等金属遇到浓硫酸会产生钝化,在金属表面产生一层致密的氧化膜,从而阻止了浓硫酸与 、 的继续反应,体现了浓硫酸的强氧化性。 注意:钝化是化学变化而非物理变化。
与非金属C,S,P反应
与其他还原性物质反应
浓硫酸与稀硫酸比较
溶质的主要存在形式
浓:
分子,不导电 稀:
、 ,强导电性 氧化性强弱
浓:强氧化性
稀:弱氧化性
遇
固体 浓:反应,产生
气体 稀:不反应
遇
、 (加热) 浓:反应
稀:不反应
脱水性
浓:有
稀:无
吸水性
浓:有
稀:无