化学变化中能量变化的主要原因
键能变化
- 物质都有能量,物质的组成、结构、状态不同,所具有的能量也不同。在化学反应中,一定有能量的变化。
- 化学键的断裂和形成需要吸收和释放能量是化学反应中能量变化的主要原因。
- 以
为例:
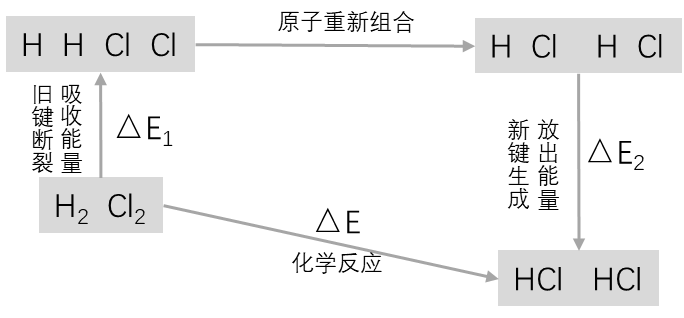
该反应释放的能量 = 生成物中化学键形成所放出的总能量 – 反应物中化学键断裂所吸收的总能量。
如果结果
气体原子结合成每摩尔 放出431KJ 的能量. 每摩 分子断裂成 气体原子, 分别需要吸收436 KJ, 243 KJ 的能量。则每生成2摩 , 反应放热183 KJ 。
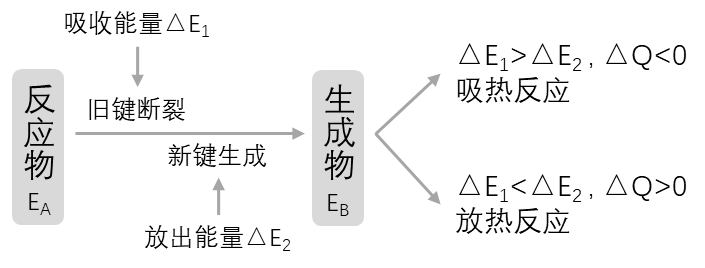
当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量,即
时,则有能量向外界释放,发生放热反应,放出的能量 ; 当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量,即
时,则需从外界吸收能量,发生吸热反应,吸收的能量 。
从总能量的角度理解化学反应过程中的能量变化
物质总能量变化
反应物总能量之和与产物能量之和不相等,所以,化学反应过程中一定存在能量变化。
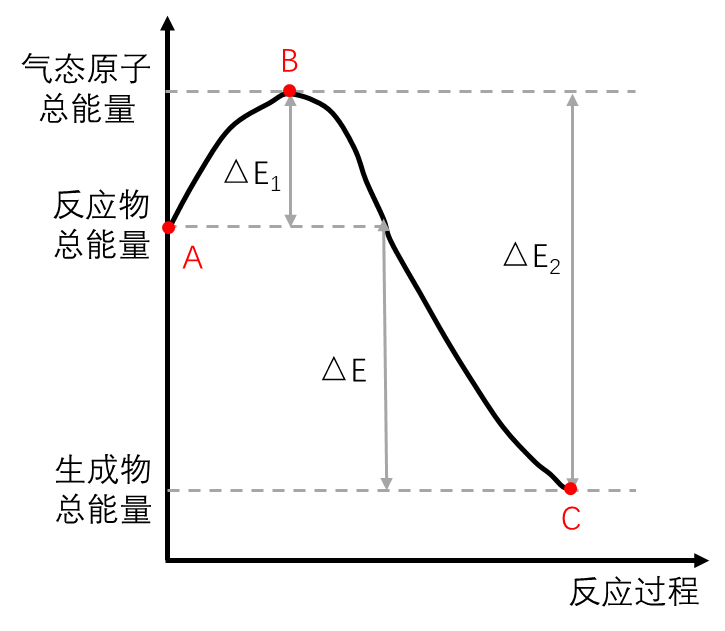
下图所示为放热反应能量变化图:
- 气体原子B转变为反应物A释放的能量少;
- 气体原子B转变为生成物C释放的能量多;
- 所以,生成物C的能量更低,更稳定。也就是C物质中键能更大,结合更牢固。
物质内部键能越大,越稳定,越不容易发生反应从而向环境释放能量,物质总能量越低。
- 反应物总能量高于产物总能量时,反应为放热反应。
放热反应特征

旧键断裂吸收的能量
小于新键生成释放的能量 。 反应物的能量
大于生成物的能量 。 反应中能量守恒,有
吸热反应:反应物的总能量小于生成物的总能量。