化学能间接转化为电能(火力发电过程)
能量转换过程:
转换的关键:燃烧 (实质是氧化还原反应)
存在的问题:使用的化石燃料属于不可再生资源;经过了多次转换,能量损耗大,燃料的利用率低,环境污染严重。
原电池—化学能直接转化为电能
实验探究:化学能转化为电能
- 实验装置:
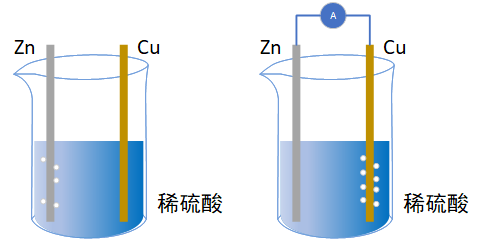
实验现象:
①锌片逐渐溶解,且锌片表面有气泡,铜片表面无明显现象。
②锌片逐渐溶解,铜片表面有气泡,且产生气泡的速度比装置①快。电流表指针发生偏转。
解释与说明:
①锌与稀硫酸发生反应,有气体生成,而铜与稀硫酸不反应。
②锌与稀硫酸反应,但产生气体的位置发生了改变,气体在铜片上生成。
③导线中产生了电流。
原电池的工作原理
定义:把化学能转化为电能的装置叫原电池。
原理示意图:
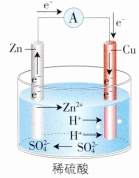
负极(
极) 发生氧化反应,电极反应式:
电子流出的一极,发生氧化反应
正极(
极) 发生还原反应,电极反应式:
电子流入的一极,发生还原反应
原电池总反应:
原电池电极反应式的书写:
①列物质,标得失:按照负极发生氧化反应,正极发生还原反应,首先确定正负极,再判断出两极的反应物与产物,找出得、失电子的数量。
②看环境,配守恒:电极产物在电解质溶液中应能稳定存在。如在酸性介质中
应结合 生成水,在碱性或中性环境中, 应结合水生成 。电极反应式要遵守电荷守恒和质量守恒、得失电子守恒等。 ③两式相加验总式:正负两极反应式相加得到电池的总反应式。也可以用总反应式减去一极反应式,得到另外一极的电极反应式。
原理解释
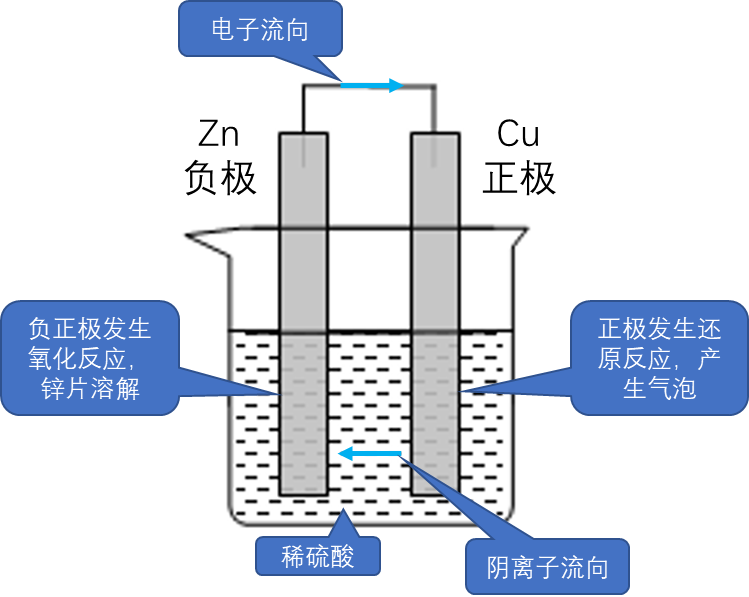
①负极发生氧化反应,正极发生还原反应。(简记:”负失氧,正得还“)
②电流方向:正极
负极(导线中) ③电子流动方向:负极
正极(导线中) ④离子移动方向:电解质溶液中,阳离子移向正极,阴离子移向负极。
构成原电池的条件
两极:
两个能导电的电极。一般为两种活动性不同的金属,其中较活泼的金属作负极,较不活泼金属作正极;
或金属与能导电的非金属(石墨等)作电极,其中金属作负极,非金属作正极。
两极材料可以参与反应,也可以不参与反应。
能自发进行的氧化还原反应。
用导线连接形成闭合回路。
电解质溶液(或熔融电解质)。